Questões de Química do ano 2017
Lista completa de Questões de Química do ano 2017 para resolução totalmente grátis. Selecione os assuntos no filtro de questões e comece a resolver exercícios.

Verificando a intensidade de mudança de cor na solução por um sensor embutido no equipamento, pode-se estimar a quantidade de álcool presente no sangue do motorista. O limite atual é 0,05 miligramas por litro de ar expirado. Nesse caso, a variação no número de oxidação do átomo de cromo presente nos íons dessa reação é igual a:
- A. 3
- B. 4
- C. 6
- D. 8
A respeito de lei de velocidade de reações químicas, observe a reação abaixo e os dados obtidos experimentalmente.

Marque a alternativa que apresenta a lei de velocidade que concorda com os dados experimentais.
- A.

- B.

- C.

- D.

Sobre os fatores que influenciam na velocidade de reações químicas, marque V para as afirmativas verdadeiras e F para as falsas.
( ) Quanto maior for a concentração dos reagentes, maior será a velocidade de reação.
( ) Colisões efetivas nem sempre levam à formação de novos produtos.
( ) Quanto maior a energia de ativação, mais rápida será a reação.
( ) Quanto maior a temperatura, maior será a velocidade de uma reação.
Assinale a sequência correta.
- A. F, V, V, F
- B. V, F, V,F
- C. V, F, F, V
- D. F, V, F, V
A entalpia-padrão de combustão do etanol líquido é -1367 kJ/mol e sua densidade é 0,80 g/mL. A energia liberada na queima de 1 litro de etanol, em kJ/mol, bem como a quantidade, em quilogramas, de CO2 liberados na atmosfera, respectivamente, serão aproximadamente:

- A. 24 e 1,5 x 10-3
- B. 2,4 x 104 e 1,5 x 10-3
- C. 24 e 1,5
- D. 2,4 x 104 e 1,5
Dada a seguinte reação:

Assinale a variação de entalpia, em kJ/mol, dessa reação.
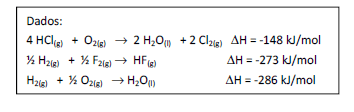
- A. -334
- B. -906
- C. -135
- D. -707
Sobre entalpia (H), assinale a afirmativa correta.
- A. A entalpia de um sistema é uma grandeza (expressa em unidades de energia) que informa a quantidade de energia desse sistema que poderia ser transformada em calor em um processo à temperatura constante.
- B. A entalpia de um sistema é uma grandeza (expressa em unidades de energia) que informa a quantidade de energia desse sistema que poderia ser transformada em calor em um processo à pressão constante.
- C. A entalpia de um sistema é uma grandeza (expressa em unidades de energia) que informa a quantidade de energia desse sistema que poderia ser transformada em calor em um processo a volume constante.
- D. A entalpia de um sistema é uma grandeza (expressa em unidades de energia) que informa a quantidade de energia desse sistema que poderia ser transformada em calor em um processo à pressão, volume e temperatura constantes.
A respeito do conceito de pressão de vapor, analise as seguintes situações.
I - Em uma cidade como Poços de Caldas, localizada a 1.196 metros acima do nível do mar, a temperatura de ebulição da água, em panela aberta, é superior a 100 °C como consequência da pressão atmosférica em Poços de Caldas ser maior que ao nível do mar.
II - Na panela de pressão fechada, a água entra em ebulição acima de 100 °C graças à retenção de parte do vapor produzido, que gera aumento da pressão interna.
III - Considerando três frascos iguais e fechados, numa mesma localidade, contendo volumes diferentes de água e todos mantidos à mesma temperatura, a pressão de vapor de água nos três frascos será a mesma em todos eles, desde que a quantidade de líquido colocada em cada um seja suficiente para que a quantidade de vapor formado atinja a pressão de vapor.
Está correto o que se afirma em
- A. II e III, apenas.
- B. I e II, apenas.
- C. I e III, apenas.
- D. I, II e III.
Um técnico de laboratório possui uma solução-mãe de 0,10 mol/L de sacarose e deseja preparar 2 L de uma solução diluída de concentração molar igual a 1 x 10-4 mol/L. O volume correto, em mililitros, a ser utilizado dessa solução-mãe no preparo da nova solução, deverá ser igual a
- A. 2 x10-3.
- B. 2 x 10-1.
- C. 2.
- D. 2 x 10-1.
Uma amostra de 25 mL de uma solução aquosa de H2SO4 foi titulada com uma solução aquosa 0,10 mol/L de KOH. Determinou-se que o volume da base necessário para atingir a viragem do indicador foi igual a 20 mL. Suponha que as titulações foram feitas em triplicata e todas forneceram os mesmos resultados. Assinale a concentração, em mol/L, de H2SO4 na solução ácida.
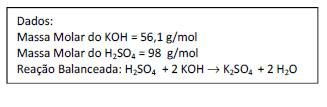
- A. 4 x 10-5
- B. 8x10-2
- C. 8 x 10-5
- D. 4 x 10-2
Uma solução de HCl foi padronizada empregando um padrão primário de Na2CO3 previamente seco em estufa por 24 horas a 110°C. Foi pesado 0,2500 g deste padrão primário e transferido para um erlenmeyer de 250 mL, sendo dissolvidos com 50 mL de água destilada e adicionadas 3 gotas de indicador alaranjado de metila. Após colocar a solução de HCl na bureta, efetuou-se a titulação, adicionando-se o ácido à solução de Na2CO3 até o ponto de viragem do indicador, cor amarela. O volume de HCl consumido foi igual a 25,00 mL. Suponha que as pesagens do padrão primário e as titulações foram feitas em triplicata e foram alcançados os mesmos valores nos três casos. Assinale a alternativa que apresenta a concentração molar aproximada do HCl que deve ser encontrada após os cálculos.
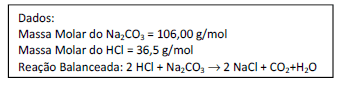
- A. 0,0943
- B. 0,1887
- C. 0,0472
- D. 0,3774


