Questões sobre Práticas Laboratoriais em química
Lista completa de Questões sobre Práticas Laboratoriais em química para resolução totalmente grátis. Selecione os assuntos no filtro de questões e comece a resolver exercícios.
Química - Práticas Laboratoriais em química - Instituto Brasileiro de Formação e Capacitação (IBFC) - 2017
Entre as técnicas laboratoriais de química, apresentamse a cristalização e secagem dos cristais. Sobre tais técnicas, assinale a alternativa incorreta.
- A. Para a cristalização, é preciso deixar a solução esfriar lentamente em frasco de Erlenmeyer, para favorecer a formação dos cristais
- B. Caso a cristalização não ocorra, pode-se induzi-la a partir da adição de alguns cristais puros do composto
- C. A imersão do frasco em líquido composto de gelo e água pode ser utilizada para completar a cristalização
- D. A indução da cristalização pode ser feita promovendose atrito nas paredes do frasco com um bastão de vidro
- E. Entre os processos de secagem dos cristais, está a simples exposição ao ambiente para compostos estáveis e higroscópicos
Química - Práticas Laboratoriais em química - Instituto Brasileiro de Formação e Capacitação (IBFC) - 2017
Entre as técnicas laboratoriais de química, apresentamse a filtração a quente e a filtração a frio. Sobre tais técnicas, assinale a alternativa correta.
- A. O processo de filtração gravitacional é meio utilizado para filtrar solução fria, para a remoção das impurezas sólidas
- B. Na filtração a quente, caso ocorra cristalização no papel ou no filtro, pode ser utilizado, solvente quente para dissolver tais cristais
- C. O processo de filtração a frio não pode ser utilizar para misturar composto resfriado de cristais e a solução
- D. Os cristais resultantes da filtração a frio devem ser lavados com um pouco de solvente quente
- E. Não se utilizam solventes quentes para que cristais sejam dissolvidos na filtração a quente
Química - Práticas Laboratoriais em química - Instituto Brasileiro de Formação e Capacitação (IBFC) - 2017
A análise gravimétrica (também conhecida como gravimetria) é o método utilizado para determinar a quantidade de um analito em uma amostra. Sobre esse tema, analise as afirmativas abaixo.
I. Análise gravimétrica é um método analítico em que são utilizadas medições de massa e informações sobre estequiometria de reação para determinar a quantidade de um analito em uma amostra.
II. Análise gravimétrica tradicional é exemplo de medição de massa de um sólido que se forma com a precipitação de um analito de uma solução.
III. Análise de combustão é exemplo de medição do ganho de massa devido à coleta de uma substância química de uma amostra.
IV. A medição da variação na massa de uma amostra de acordo com a variação de temperatura está relacionada à análise termogravimétrica.
Está correto o que se afirma em:
- A. I, II, III e IV
- B. I, II e III, apenas
- C. III e IV, apenas
- D. II e III, apenas
- E. I, II e IV, apenas
Química - Práticas Laboratoriais em química - Centro de Seleção e de Promoção de Eventos UnB (CESPE) - 2017
Julgue os itens subsequentes, a respeito dos diversos aspectos relacionados à área de pesquisa em ensino de química. O domínio do conhecimento químico é condição suficiente para a pesquisa em ensino de química.
- C. Certo
- E. Errado
Química - Práticas Laboratoriais em química - Centro de Seleção e de Promoção de Eventos UnB (CESPE) - 2017
A química é muito importante para a compreensão do ambiente e das transformações que nele acontecem, sejam elas naturais ou não.
Com relação às transformações e aos fenômenos químicos que acontecem no ambiente, julgue os próximos itens.
Uma chuva cujo pH seja igual a seis é considerada chuva ácida.- C. Certo
- E. Errado
O principio básico da determinação de ferro total, em amostras de água superficial, é a reação entre o ferro que é solubilizado e posteriormente
- A. oxidado ao estado férrico por ebulição em meio ácido e hidroxilamina, com fenolftaleina em pH 3,2 a 3,3.
- B. oxidado ao estado férrico por ebulição em meio ácido e hidroxilamina, com 1,10-fenantrolina em pH 3,2 a 3,3.
- C. oxidado ao estado férrico por ebulição em meio básico e hidroxilamina, com 1,10-fenantrolina em pH 3,2 a 3,3.
- D. reduzido ao estado ferroso por ebulição em meio ácido e hidroxilamina, com 1,10-fenantrolina em pH 3,2 a 3,3.
- E. oxidado ao estado férrico por ebulição em meio básico e hidroxilamina, com fenolftaleina em pH 3,2 a 3,3.
A escolha do método para a realização de testes bacteriológicos normalmente leva em consideração as condições operacionais do laboratório, sabendo-se que, para adequar-se às legislações vigentes, deve-se utilizar um método reconhecido como norma dentro da comunidade científica. Um dos métodos utilizados pela facilidade do manuseio e pela boa relação custo/benefício é o do Substrato Cromogênico-Fluorogênico Definido. Este teste se baseia na atividade enzimática específica dos coliformes ( galactosidade) e Escherichia Coli ( glucoromidase), onde, após o período de incubação no meio de cultura, ocasionará mudança de cor, já que contém nutrientes indicadores (substrato). Se a cor
- A. A escolha do método para a realização de testes bacteriológicos normalmente leva em consideração as condições operacionais do laboratório, sabendo-se que, para adequar-se às legislações vigentes, deve-se utilizar um método reconhecido como norma dentro da comunidade científica. Um dos métodos utilizados pela facilidade do manuseio e pela boa relação custo/benefício é o do Substrato Cromogênico-Fluorogênico Definido. Este teste se baseia na atividade enzimática específica dos coliformes ( galactosidade) e Escherichia Coli ( glucoromidase), onde, após o período de incubação no meio de cultura, ocasionará mudança de cor, já que contém nutrientes indicadores (substrato). Se a cor
- B. amarela for identificada, há a presença de coliformes totais. Caso a fluorescência azul seja observada sob luz ultravioleta (UV) a 365 nm, a Escherichia Coli estará ausente.
- C. amarela for identificada, há a presença de coliformes totais. Caso a fluorescência azul seja observada sob luz ultravioleta (UV) a 365 nm, a Escherichia Coli estará presente.
- D. amarela for identificada, há a presença de coliformes totais. Caso a fluorescência verde seja observada sob luz ultravioleta (UV) a 365 nm, a Escherichia Coli estará presente.
- E. verde for identificada, há a presença de coliformes totais. Caso a fluorescência vermelha seja observada sob luz ultravioleta (UV) a 365 nm, a Escherichia Coli estará presente.
A determinação de nitrato (NO3-), em amostras de água superficial, visa investigar a presença deste ânion que, dentre outros fatores, pode causar metamoglobinemia, doença conhecida como síndrome do bebê azul. A determinação envolve a redução dos íons nitrato a íons
- A. nitrito, em uma coluna de cádmio na forma de grânulos, tratada com sulfato de cobre (CuSO4) e posteriormente determinado por espectrofotometria.
- B. amônio, em uma coluna de cádmio na forma de grânulos, tratada com sulfato de cobre (CuSO4) e posteriormente determinado por espectrofotometria.
- C. nitrito, em uma coluna de zinco na forma de grânulos, tratada com sulfato de cobre (CuSO4) e posteriormente determinado por espectrofotometria.
- D. nitrito, em uma coluna de chumbo na forma de grânulos, tratada com sulfato de cobre (CuSO4) e posteriormente determinado por espectrofotometria.
- E. nitrito, em uma coluna de cádmio na forma de grânulos, tratada com sulfato de cobre (CuSO4) e posteriormente determinado por eletrogravimetria.
A determinação dos íons sulfato, seja em águas estuarinas ou em águas doces, é bastante utilizada para estudos da qualidade dessas águas. Existem dois métodos bastante utilizados: o turbidimétrico e o gravimétrico. Ambos utilizam o mesmo princípio, no entanto, na análise turbidimétrica, o precipitado formado
- A. fica em estado coloidal como sulfato de chumbo e, na análise gravimétrica, é seco, decantado, calcinado e pesado como sulfato de bário.
- B. fica em estado coloidal, já na análise gravimétrica, o precipitado é decantado, seco, calcinado e pesado como sulfato de cobre.
- C. fica em estado coloidal, assim também ocorre na análise por gravimetria.
- D. fica em estado coloidal, já na análise gravimétrica, o precipitado é decantado, seco, calcinado e pesado como sulfato de bário.
- E. é decantado e pesado, enquanto, na análise por gravimetria, é seco e pesado como sulfato de bário.
A alcalinidade de uma água natural é a capacidade que ela possui de neutralizar ácidos. Pode ser calculada de forma separada, tendo em vista as diferentes formas de alcalinidade: bicarbonatos, carbonatos e hidróxidos. Um estudante do IFCE realizou a análise de alcalinidade pelo método titulométrico, utilizando ácido sulfúrico como titulante e, após o processamento dos seus cálculos, encontrou os seguintes valores de alcalinidades parciais, em mg/l-1 como CaCO3:
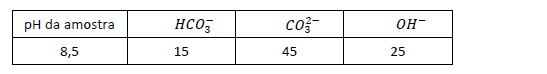
Com a análise dos dados, é correto deduzir-se que os cálculos estão
- A. errados, pois não há como ter, em uma mesma amostra, os 3 tipos de alcalinidade parcial.
- B. errados, pois, nesse pH, só é possível ter alcalinidade parcial de hidróxidos.
- C. certos, pois, nesta faixa de pH, a alcalinidade de carbonatos é sempre maior que a de bicarbonato.
- D. certos, pois a alcalinidade de carbonato, nesse pH, representa um terço da alcalinidade de bicarbontato.
- E. certos, pois, nesse pH, a espécie que apresenta maior concentração é o carbonato, devido à sua hidrólise em meio aquoso.


