Questões de Engenharia Química do ano 2014
Lista completa de Questões de Engenharia Química do ano 2014 para resolução totalmente grátis. Selecione os assuntos no filtro de questões e comece a resolver exercícios.
O processo de tratamento biológico de um efluente doméstico pode ser aeróbico ou anaeróbico. Além da diferença na quantidade de lodo produzido, o processo anaeróbico apresenta a
- A. remoção de metais pesados como cianetos.
- B. alteração da flora microbiana para uma única espécie.
- C. adsorção de gases contendo voláteis orgânicos.
- D. desinfecção natural da água.
- E. transformação da maior parte da matéria orgânica em gás metano e gás carbônico.
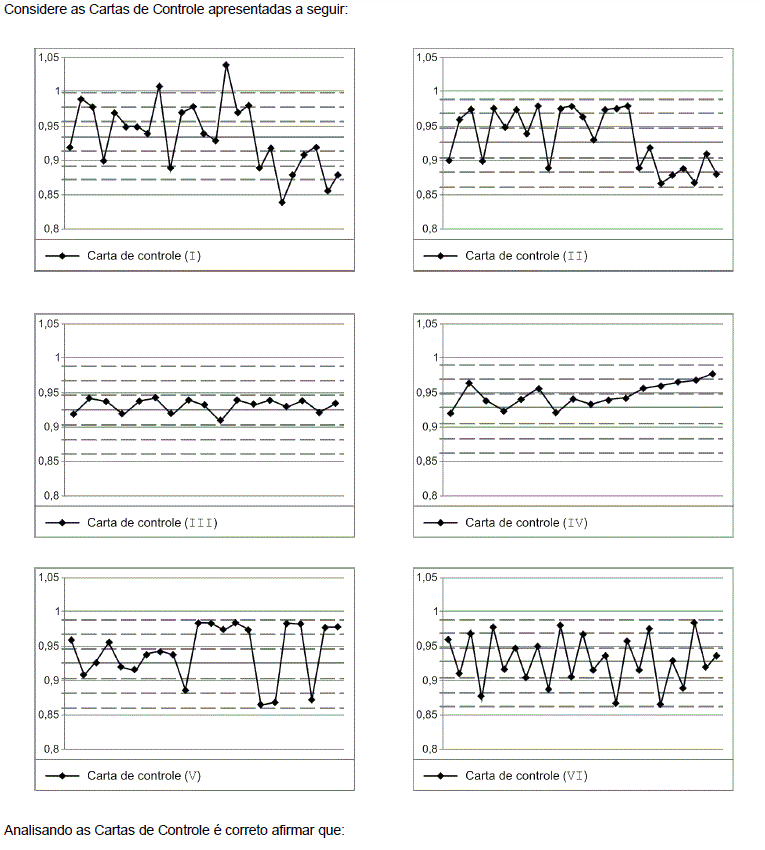
- A. Nenhum dos processos pode ser considerado adequadamente controlado.
- B. As cartas de controle II, III, IV, V e VI representam processos controlados, pois os pontos encontram-se dentro dos limites estipulados.
- C. Todos os processos estão adequadamente controlados, com exceção dos processos representados pelas cartas (I) e (V). A (I) por ter os pontos muito dispersos e a (V) por ter mais de 50% dos pontos acima ou abaixo da linha de 2/3 em relação à linha central.
- D. Apenas os processos representados pelas cartas (III) e (VI) estão adequadamente controlados, por terem a dispersão dos pontos alternados em relação à linha central.
- E. Apenas os processos representados pelas cartas (II) e (IV) estão adequadamente controlados, por terem a maioria dos pontos em apenas um dos lados da linha central.
A água, a amônia e o metano têm massas moleculares próximas. Apesar disto, a água possui ponto de ebulição muito mais elevado que os da amônia e do metano. Essas observações experimentais podem ser explicadas porque:
- A. Os tipos de ligações não interferem no ponto de ebulição.
- B. Todos os três compostos apresentados têm ligações covalentes, porém o metano e amônia são polares.
- C. As moléculas de água têm as ligações covalentes oxigênio-hidrogênio facilmente rompíveis.
- D. A água possui moléculas polares que formam ligações de pontes de hidrogênio, aumentando a força de coesão entre as moléculas.
Num determinado tratamento de água, utilizou-se 0,355 mg de cloro (Cl2) por litro de água. O número de moléculas de cloro utilizadas por litro foi de:
- A. 3,01.1018
- B. 3,01.1019
- C. 6,02.1018
- D. 6,02.1023
Um solvente puro tem temperatura de ebulição(te) e temperatura de solidificação (ts). Acondicionando-se soluto não volátil ao solvente, as temperaturas de ebulição e solidificação para a solução serão (te) e (ts), respectivamente. É correto afirmar que:
- A. te < te e ts < ts
- B. te < te e ts > ts
- C. te > ts e ts > ts
- D. te > te e ts < ts
De acordo com a lei de Robert Boyle (1660), para proporcionar um aumento na pressão de uma determinada amostra gasosa numa transformação isotérmica, é necessário:
- A. Diminuir sua massa.
- B. Aumentar a sua temperatura.
- C. Diminuir o seu volume.
- D. Aumentar sua massa.
Uma solução aquosa 0,045 mol/L de ácido acético, CH3COOH, apresenta o ácido 2% dissociado em H+ e CH3COO-. A concentração de cada um desses íons na solução é:
- A. 9.10-4 mol/L
- B. 9.10-6 mol/L
- C. 9.10-2 mol/L
- D. 9.10-1 mol/L
O cloreto de carbonilo gasoso decompõe-se, à temperatura T, em monóxido de carbono e cloro molecular. Este sistema gasoso atinge um estado de equilíbrio, para o qual as espécies têm as seguintes concentrações:
[COCl2] = 1,60 mol/dm3
[CO] = 0,40 mol/dm3
[Cl2] = 0,40 mol/dm3
O valor da constante de equilíbrio é:
- A. 0,5
- B. 10
- C. 0,10
- D. 0,25
O grande volume de esgotos clandestinos lançados nos mananciais da Grande São Paulo é uma das causas das proliferações de algas microscópicas nocivas. Essas algas comprometem a qualidade da água. Concentrações de CO2 acima do limite de 2,5.10-3 mol/L aceleram o crescimento de alguns tipos de algas. Numa represa com 5.000 litros de água, assinale a alternativa correspondente à massa limite (em kg) de CO2 citada acima:
- A. 0,55
- B. 1,10
- C. 2,20
- D. 5,50
Assinale abaixo qual alternativa é incorreta acerca de um equilíbrio químico:
- A. Obrigatoriamente, as concentrações de todas as substâncias participantes do equilíbrio devem ser iguais.
- B. A velocidade da reação direta é igual à velocidade da reação inversa.
- C. Ambas as reações (direta e inversa) ocorrem simultaneamente (trata-se de um equilíbrio dinâmico).
- D. As características macroscópicas do sistema (desde que fechado) não mais se alteram.


