Questões sobre Química Cinética
Lista completa de Questões sobre Química Cinética para resolução totalmente grátis. Selecione os assuntos no filtro de questões e comece a resolver exercícios.
Avalie as afirmações que seguem com base no tema Gás perfeito confinado em um recipiente de volume invariável.
I. A energia cinética de um gás equivale ao somatório das energias cinéticas de suas moléculas.
II. A energia cinética média por molécula de um gás não depende de sua natureza, e sim de sua temperatura.
III. A energia cinética média por molécula de um gás depende de sua natureza e também de sua temperatura.
Está correto o que se afirma em:
- A. II e III, apenas
- B. I e II, apenas
- C. I e III, apenas
- D. I, II e III
- E. III, apenas
Após a leitura do enunciado apresentado a seguir, identifique a afirmação correta:
A pressão medida em relação à pressão atmosférica, tomada como unidade de referência que pode ser chamada de pressão relativa positiva ou pressão relativa negativa. Recebe o nome de pressão:
- A. Atmosférica.
- B. Diferencial.
- C. Manométrica.
- D. Absoluta.
A química é uma ciência que explica o mundo macroscópico por meio de modelos microscópicos com uma linguagem própria que representa as substâncias e suas transformações. A esse respeito, julgue os itens a seguir. Conforme a teoria cinética dos gases, a energia cinética independe da temperatura.
- C. Certo
- E. Errado
A transformação de energia de suas fontes primárias para a forma como é usada ocorre, geralmente, por meio de mais de um processo de conversão. A energia elétrica, por exemplo, não é uma fonte primária de energia, mas resultado de um processo de conversão iniciado com fontes de energia diferenciadas. Em uma célula solar, a luz incidente produz eletricidade, que, por sua vez, pode ser utilizada para movimentar um motor elétrico.
Tendo como referência o texto precedente, assinale a opção que apresenta os tipos de energia envolvidos no processo de conversão de energia que ocorre, respectivamente, em um termopar, em uma turbina e em um gerador.
- A. térmica para mecânica, térmica para elétrica, mecânica para elétrica
- B. química para mecânica, elétrica para térmica, mecânica para térmica
- C. térmica para elétrica, química para elétrica, térmica para mecânica
- D. mecânica para elétrica, mecânica para química, elétrica para mecânica
- E. térmica para elétrica, térmica para mecânica, mecânica para elétrica
O teste de jarros é considerado um importante ensaio para a simulação do processo de coagulação em uma planta de tratamento de água. Por meio desse ensaio, podem ser determinados os melhores valores de dosagem de agentes coagulantes (ou proporções entre agentes coagulantes e auxiliares de coagulação), tempo de mistura e tempo de operação. Uma amostra de água, com turbidez inicial de 24 NTU, foi submetida a testes de jarros, onde as misturas A e B foram usadas como coagulantes, em diversas concentrações. Os resultados são apresentados na figura a seguir.
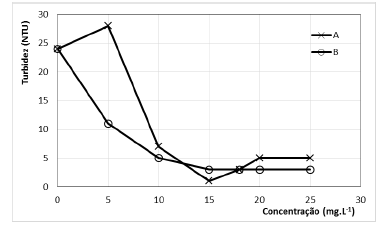
O processo de coagulação se mostrou mais eficiente ao
- A. adotar a mistura A, em concentração de 5 mg.L1.
- B. adotar a mistura A, em concentração de 15 mg.L1.
- C. adotar a mistura A, em concentração de 25 mg.L1.
- D. adotar a mistura B, em concentração de 15 mg.L1.
- E. adotar a mistura B, em concentração de 25 mg.L1 .
O diagrama de fases para o gás carbônico, CO2, a baixas pressões, é mostrado a seguir.
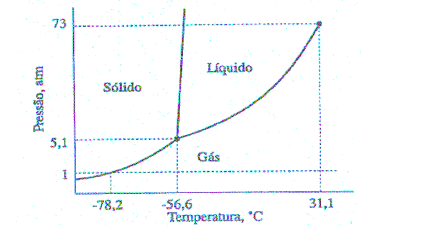
Todas as alternativas abaixo estão de acordo com as informações fornecidas, EXCETO
- A. O CO2 pode sublimar a qualquer pressão abaixo de 5,1 atm.
- B. Em 1 atm de pressão, a temperatura de sublimação do gelo seco é de -78,2°C.
- C. Em 5,1 atm de pressão, o CO2 encontra-se nos estados sólido, líquido e gasoso.
- D. O dióxido de carbono sólido, gelo seco, funde-se a 1 atm de pressão.
Julgue os itens a seguir, relativos ao tempo de residência e ao aumento de escala em processos de extrusão de materiais plásticos.
A curva de distribuição de tempo de residência identificada pelo algarismo 1 no gráfico mostrado abaixo resulta do elemento de rosca representado pela letra A.
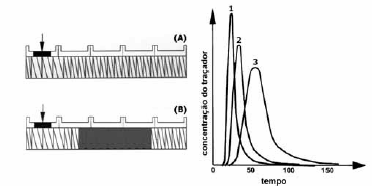
- C. Certo
- E. Errado
Química - Química Cinética - Centro de Produção da Universidade Federal do Rio de Janeiro (CEPERJ) - 2014
Um sal hidratado é analisado por gravimetria para determinação de sua composição. Inicialmente é aquecido até perder a água de cristalização, tornado-se um sal anidro. Em seguida, a temperatura é aumentada até ocorrer a decomposição térmica do sal. Analisando grafi camente o processo, medindo-se a variação de massa (m) em função da temperatura (θ), o gráfi co que melhor representa os resultados obtidos é:
- A.

- B.

- C.

- D.

- E.

Química - Química Cinética - Fundação para o Vestibular da Universidade Estadual Paulista (VUNESP) - 2013

- A.
Se a reação se processar pelo caminho I, será mais rápida.
- B.
A adição de um catalisador à reação diminui o valor de ΔH.
- C.
A curva II refere-se à reação catalisada e a curva I refere- se à reação não catalisada.
- D.
O complexo ativado da curva I apresenta a mesma energia do complexo ativado da curva II.
- E.
A adição do catalisador transforma a reação endotérmica em exotérmica.
Em reações de substituição nucleofílica Sn2 entre um haleto de alquila e um nucleófilo,
- A.
apenas a concentração do nucleófilo influencia a cinética da reação.
- B.
entre as ligações químicas do haleto de alquila não há polarização.
- C.
a quebra da ligação do haleto de alquila é do tipo heterolítica.
- D.
a cinética da reação é unimolecular.
- E.
o haleto ligado à cadeia alquílica representa um centro eletrofílico.


