Questões de Engenharia Química do ano 2011
Lista completa de Questões de Engenharia Química do ano 2011 para resolução totalmente grátis. Selecione os assuntos no filtro de questões e comece a resolver exercícios.
Considere o texto abaixo para responder às questões de nos 4 a 6.
Pretende-se destilar 200 mol/h de uma mistura binária, líquida saturada, formada por 60% de benzeno e 40% de tolueno em base molar. Deve-se produzir um destilado com 95% molar de benzeno e um produto de fundo com 5% molar de benzeno. A alimentação é líquido saturado. A volatilidade relativa é constante e igual a 5. Usando a Equação de Fenske, o número de estágios, a refluxo total, é- A. menor que 5.
- B. 6
- C. 7
- D. 8
- E. maior que 9

- A.

- B.

- C.

- D.

- E.


- A. 0
- B. 3
- C. 6
- D. 12
- E.

Considere um ciclo de potência a vapor simples em que:
o fluido de trabalho passa por seus vários componentes sem irreversibilidades; não existe queda de pressão por atrito na caldeira e no condensador e o fluido de trabalho fluirá através desses componentes a pressão constante; não existem irreversibilidades e transferência de calor com as vizinhanças; os processos, através da turbina e através da bomba, são isentrópicos. Trata-se de um ciclo- A. regenerativo.
- B. de Carnot.
- C. de reaquecimento.
- D. supercrítico.
- E. ideal de Rankine.
Quando um fluido escoa através de uma restrição, como um orifício, uma válvula parcialmente fechada ou um tampão poroso, sem qualquer variação apreciável de energia cinética ou potencial, e na ausência de transferência de calor, realiza-se um processo
- A. isotérmico.
- B. isentálpico.
- C. isentrópico.
- D. isobárico.
- E. isocórico.
Em relação à pressão de vapor de um líquido, é INCORRETO afirmar que
- A. a pressão de vapor de um líquido aumenta linearmente com o aumento da temperatura.
- B. a curva de pressão de vapor relaciona pressão a temperatura, sendo que, em qualquer ponto acima da curva, existem duas fases, líquido e vapor.
- C. a pressão de vapor pode ser estimada por meio de equações empíricas.
- D. a Equação de Clapeyron estabelece uma relação termodinâmica entre pressão de vapor e entalpia de vaporização de uma substância pura.
- E. um líquido puro entra em ebulição, em dada temperatura, quando sua pressão de vapor é igual à pressão à qual está submetido.
Um gás com comportamento ideal é comprimido isotermicamente do estado caracterizado por pressão e volume molar iguais a p1 e V1 para outro cujos valores são p2 e V2. Qual a variação de energia interna ocorrida entre os estados 1 e 2, em J/mol? (T = temperatura absoluta e R = constante dos gases)
- A. p2.V1 p1.V2
- B. p1.V2 p2.V1
- C. 0
- D. R.T
- E.

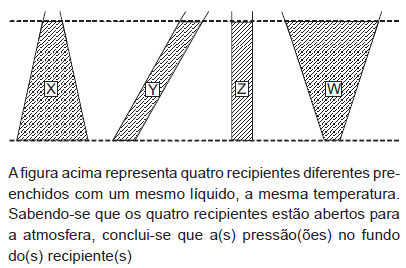
- A. X é maior que no fundo dos demais recipientes.
- B. Y é maior que no fundo dos demais recipientes.
- C. Z é maior que no fundo dos demais recipientes.
- D. W é maior que no fundo dos demais recipientes.
- E. X, Y, Z e W são iguais.
Um oleoduto com 6 km de comprimento e diâmetro uniforme opera com um gradiente de pressão de 40 Pa/m transportando um derivado de petróleo de massa específica 800 kg/m3. Se a cota da seção de saída do oleoduto situa-se 14 m acima da cota de entrada, e considerando que a aceleração da gravidade local é 10 m/s2, a perda de carga total associada ao escoamento, em m, é
- A. − 44
- B. - 16
- C. 16
- D. 28
- E. 44
Um fluido newtoniano incompressível escoa numa certa temperatura em uma tubulação vertical, de baixo para cima, com dada vazão. Nesse caso, a queda de pressão (maior pressão - menor pressão) e a perda de carga associadas são, respectivamente, x e y. Se o mesmo fluido escoar com as mesmas vazão e temperatura, na mesma tubulação, de cima para baixo, a queda de pressão e a perda de carga associadas são, respectivamente, z e w, donde se conclui que
- A. x < z
- B. x = z
- C. x > z
- D. y > w
- E. y < w


