Questões de Engenharia Química do ano 2011
Lista completa de Questões de Engenharia Química do ano 2011 para resolução totalmente grátis. Selecione os assuntos no filtro de questões e comece a resolver exercícios.
Considere o quadro a seguir:
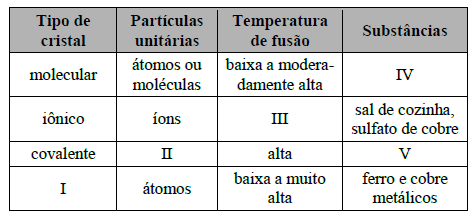
Nesse quadro, foram deixadas lacunas indicadas pelos algarismos I, II, III, IV e V. A alternativa que apresenta um preenchimento INCORRETO da lacuna é:
- A.
I metálico.
- B.
II átomos.
- C.
III baixa.
- D.
IV naftaleno, iodo e gelo seco.
- E.
V carborundum e carbeto de tungstênio.
O sulfato cúprico pode ser utilizado na alimentação animal e como fonte dos nutrientes Cu e S para a nutrição das plantas. Esse sal pode ser obtido pela reação entre o óxido de cobre II e o ácido sulfúrico. Considerando que a reação referida anteriormente ocorra com 100% de rendimento, para um sistema contendo 10 mols de óxido cúprico e 1,3 kg de ácido sulfúrico, pode-se afirmar que: (Dados: Massas molares (g/mol) => Cu = 63,5 g mol1; S = 32,0 g mol1; O = 16,0 g mol1; H = 1,0 g mol1)
- A.
A adição de maior quantidade de H2SO4 ao sistema aumenta a massa de CuSO4 formada.
- B.
A quantidade de CuSO4 formada será inferior a 2,0 kg.
- C.
A quantidade de matéria de CuSO4, no final da reação, será igual à quantidade de matéria de H2SO4 no início da reação.
- D.
A solução resultante será neutra após a reação ter-se completado.
- E.
O sistema contém CuO após a reação ter-se completado.
A partir de 1982, a União Internacional de Química Pura e Aplicada (IUPAC) alterou o valor da pressão padrão, de forma que as novas Condições Normais de Temperatura e Pressão (CNTPs) passaram a ser:

- A.
22,4
- B.
30,2
- C.
22,7
- D.
0,0224
- E.
0,0227
Em um recipiente contendo 1,08 g de cloreto de bário diidratado foi adicionado excesso de solução de nitrato de prata. Em seguida, o precipitado obtido foi filtrado e seco em estufa. Considere que o processo foi realizado com 100% de rendimento. (Dados: Massas molares (g/mol) => Ba = 137,00, Cl = 35,50, Ag = 108,00, H = 1,00, O = 16,00) Marque a alternativa em que o valor mais se aproxima da massa (em g) do precipitado obtido:
- A.
1,26
- B.
2,32
- C.
1,63
- D.
2,20
- E.
1,47
Num balão de vidro (1,00 L) a 25ºC hermeticamente fechado e pressão de 1 atm, foram adicionadas quantidades equimolares de hidrogênio gasoso e de vapor de iodo. Para esse sistema, a equação da velocidade (v) da reação elementar de formação do iodeto de hidrogênio deve ser escrita da seguinte forma:
- A.
(k1/k2) [H2] ([I2]/[HI]2) mol/L.s
- B.
k1 [H2] [I2] mol/L.s
- C.
k [HI]2 / ([H2] [I2]) mol/L.s
- D.
k1 [H2]2 [I2]0 mol/L.s
- E.
[HI]2 / ([H2] [I2]) mol/L.s
O trióxido de enxofre decompõe-se à alta temperatura em um recipiente selado, em dióxido de enxofre e gás oxigênio. Inicialmente, o recipiente é abastecido a 1000 K com trióxido de enxofre a uma pressão parcial de 0,500 atm. No equilíbrio, a pressão parcial desse mesmo gás passa a ser 0,200 atm. Qual é o valor da constante de equilíbrio para esse sistema?
- A.
0,300 atm
- B.
0,338 atm
- C.
2,667 atm
- D.
0,375 atm
- E.
2,958 atm
Marque V para as afirmativas verdadeiras e F para as falsas:
( ) No caso de um soluto cuja solubilidade diminui com o aumento da temperatura, pode-se conseguir uma solução supersaturada, preparando-se uma solução saturada a uma temperatura, filtrando o excesso de soluto e depois aquecendo-a.
( ) A adição de álcool a uma solução aquosa de NaCl favorecerá a precipitação do sal desde que a constante dielétrica do álcool seja maior que a da água.
( ) A pressão de vapor aumenta quando se adiciona um soluto não-volátil ao líquido puro.
( ) Se a energia reticular do AgCl for 904 kJ mol1, a energia de hidratação do Ag+1 for 469 kJ mol1 e a energia de hidratação do Cl1 for 377 kJ mol1, pode-se afirmar que o processo de dissolução do referido sal será exotérmico.
( ) A tendência de escape para um solvente é medida pela sua pressão de vapor.
( ) A alteração no ponto de ebulição é proporcional à molalidade das partículas do soluto.
( ) A presença de um soluto sempre diminui o ponto de congelação, se o soluto é solúvel na fase líquida e insolúvel na fase sólida.
( ) Osmose reversa representa o emprego de uma pressão superior à pressão osmótica para remover o solvente de uma solução.
A sequência está correta em:
- A.
V, F, F, V, V, V, F, V
- B.
F, F, F, F, V, V, F, V
- C.
V, F, F, V, V, V, V, V
- D.
F, V, V, F, F, F, V, F
- E.
V, F, F, F, V, V, V, V
A massa de 5,00g de formamida (composto não volátil) foi dissolvida em 100,00g de água a 30ºC. A pressão de vapor da solução resultante foi medida e o valor observado foi de 31,20 mmHg. Considerando que a pressão de vapor da água pura é 31,82 mmHg nessa mesma temperatura, qual é o valor aproximado da massa molecular da formamida?
- A.
98 u
- B.
45 u
- C.
60 g/mol
- D.
272 u
- E.
272 g/mol
Um composto A apresenta fórmula molecular C8H6 e reage com bromo em tetracloreto de carbono. A seguir, são apresentadas algumas afirmativas a respeito deste composto. Analise-as:
I. O valor do Índice de Deficiência de Hidrogênio (IDH) para o composto A é igual a 4.
II. O valor de IDH igual a 4 pode ser interpretado como a presença de um anel aromático na molécula.
III. O composto A é saturado ou contém anel aromático, pois reage por adição com bromo em tetracloreto de carbono.
Está(ão) correta(s) apenas a(s) afirmativa(s):
- A.
II
- B.
III
- C.
I, II
- D.
II, III
- E.
I, II, III
Conhecer o teor de cloro ativo que permanece após a desinfecção (cloração) da água, permite assegurar a qualidade microbiológica da mesma, ou seja, certificar-se que ela está atendendo aos padrões estabelecidos para o consumo humano. As reações a seguir estão relacionadas à determinação quantitativa de cloro residual. Observe:
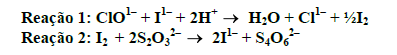
Em relação às determinações quali e quantitativas do cloro residual em amostras de água, é correto afirmar que, EXCETO:
- A.
O ânion clorado representado na reação 1 pode ter sido originado a partir do hipoclorito de sódio.
- B.
O ácido hipocloroso, responsável pelo processo de desinfecção, pode ser originado a partir da hidrólise do ânion hipoclorito.
- C.
Na reação 1, o íon iodeto reduz o átomo de cloro presente no ânion hipoclorito. Na reação 2, o iodo formado é reduzido pelo ânion tiossulfato. O ponto final da titulação pode ser visualizado, utilizando-se amido como indicador. A presença de uma coloração violeta indica que ainda existe iodo sem reagir.
- D.
A análise qualitativa para determinação de cloro residual é realizada utilizando-se a ortotolidina como reagente. A observação de coloração roxa após a adição desse reagente indica a presença de cloro livre.
- E.
O teor mínimo de cloro residual livre entre 0,2 0,5 mg/L equivale a uma concentração na faixa de 200 500 ppb.


