Questões de Engenharia Química do ano 2017
Lista completa de Questões de Engenharia Química do ano 2017 para resolução totalmente grátis. Selecione os assuntos no filtro de questões e comece a resolver exercícios.
Para misturas binárias, as condições de equilíbrio para várias composições podem ser facilmente visualizadas em diagramas do tipo Txy e xy, à pressão constante, ou Pxy e xy, à temperatura constante.
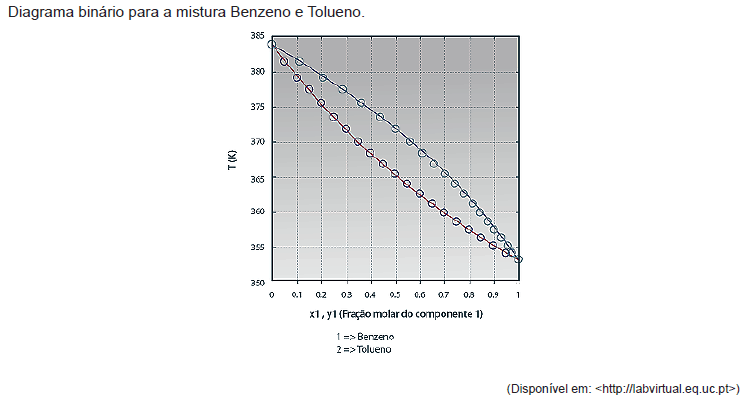
Após análise do diagrama, pode-se afirmar que a mistura com fração de
- A. 0,7mol de benzendo a 360K encontra-se no ponto de bolha.
- B. 0,4mol de tolueno a 370K encontra-se 33% no estado líquido.
- C. 0,6mol de benzeno a 365K possui aproximadamente 48% de vapor.
- D. 0,2mol de tolueno a 360K possui aproximadamente 85% de líquidos.
Muitas equações para o estudo de gases reais têm sido desenvolvidas, algumas são bem exatas. A equação de estado mais conhecida para os gases reais é a equação de Van Der Waals:
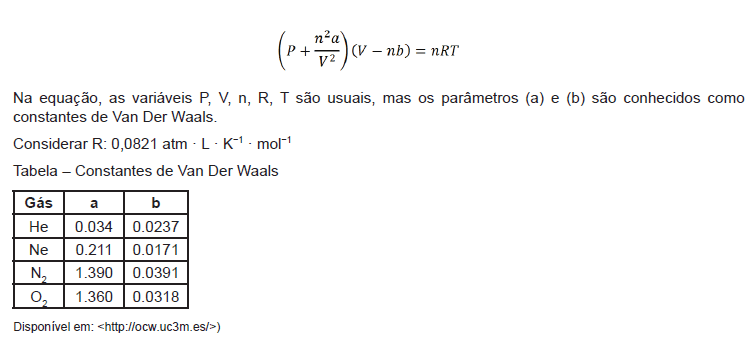
Utilizando a equação de Van Der Waals para gases reais, calcule a pressão real exercida por 16 gramas de gás oxigênio que se encontra em um recipiente de 1L a 27°C.
- A. 12,17atm.
- B. 12,31atm.
- C. 14,8atm.
- D. 24,63atm.
Em um recipiente é mantida uma determinada massa de gás perfeito, tendo um volume inicial (Vi), pressão inicial (Pi) e temperatura inicial igual a 127oC. Se o sistema for alterado para um volume (Vi/3) e a pressão (3Pi/2), qual será a temperatura do gás no recipiente em °C?
- A. -73.
- B. 63,5.
- C. 200.
- D. 473.
Muitos foram os pesquisadores que contribuíram para as leis conhecidas como Leis dos Gases. Algumas das contribuições mais importantes dos gases ideais estão resumidas nos postulados na lei de Boyle, lei de Charles, lei de Gay-Lussac e lei de Clapeyron. Com relação às leis dos gases, analise as afirmativas a seguir.
I. De acordo com a lei de Boyle, a pressão e o volume de um gás são inversamente proporcionais entre si para um gás ideal.
II. De acordo com a lei de Gay-Lussac, a velocidade de difusão e de efusão de um gás é inversamente proporcional à raiz quadrada de sua densidade.
III. De acordo com a lei de Charles, o volume de um gás é diretamente proporcional à sua temperatura absoluta.
IV. De acordo com a lei de Clapeyron, à volume constante, a pressão de uma certa massa constante de um gás é proporcional à temperatura absoluta a qual está submetida.
Está correto apenas o que se afirma em
- A. I e III.
- B. II e III.
- C. III e IV.
- D. I, II e IV.
A cavitação é um fenômeno indesejado no funcionamento das máquinas de fluxo e ocorre em regiões de altas velocidades e baixa pressão dos tubos de sucção em máquinas motoras e geradoras. Ela pode provocar corrosão, desgaste, remoção de partículas e destruição de partes dos rotores das bombas. Tal circunstância faz com que as condições de sucção tenham papel importante no projeto e nas especificações das instalações para o correto funcionamento, tanto de bombas quanto de turbinas.
Com relação ao funcionamento de máquinas de fluxo e o fenômeno da cavitação, marque a alternativa correta.
- A. Aço doce laminado é utilizado em substituição ao Aço cromo, por ter maior resistência à cavitação.
- B. Peças em ferro fundido têm alta resistência à cavitação e o aparecimento de corrosão por placas é bem pronunciado.
- C. Revestimento das partes internas do material com elastômetros geram resistência do metal e eliminam a cavitação.
- D. Metais de alta tenacidade podem resistir ao desgaste por um período, mas ocorre, eventualmente, ataque a grandes áreas.
Uma empresa distribuidora de gás oxigênio possui dois cilindros no depósito. Admitindo o comportamento deste gás análogo ao gás ideal e conectando-se os dois cilindros, um com volume de 8L e pressão interna de 5atm, e outro com volume 12L e pressão interna de 10atm, quando a válvula que os une for aberta, é atingido o equilíbrio entre os dois tanques à temperatura constante. Marque a alternativa que apresenta corretamente a pressão final nos tanques.
- A. 6atm.
- B. 7atm.
- C. 8atm.
- D. 9atm.
Inibidor de corrosão é uma substância ou mistura de substâncias que, quando presente em concentrações adequadas, no meio corrosivo, reduz ou elimina a corrosão. As seguintes afirmativas referem-se ao inibidor de corrosão.
I. Inibidores protetivos emulsionáveis em água deixam por evaporação uma película oleosa aplicada por diluição em água.
II. O método de proteção usando protetivos temporários é baseado na obtenção de uma película superficial, fácil de aplicar e remover.
III. Inibidores catódicos têm a capacidade de formar películas sobre as áreas anódicas e catódicas, interferindo com a ação eletroquímica.
IV. Inibidores anódicos atuam favorecendo as reações anódicas, protegendo o cátodo da corrosão. São eficazes, mesmos em pequenas concentrações.
Está correto apenas o que se afirma em
- A. I e II.
- B. II e IV.
- C. I, III, IV.
- D. I, II e IV.
A Equação de Nernst, desenvolvida pelo químico e físico alemão Walther Hermann Nernst, é a relação quantitativa que permite calcular a força eletromotriz de uma pilha para concentrações de íons diferentes de uma unidade. Também é usada para cálculos em titulação de oxidação-redução.

- A. 0,81V.
- B. 0,84V.
- C. 0,86V.
- D. 1,13V.
Um profissional preparou uma solução dissolvendo 0,10mol de nitrato de cálcio [Ca(NO3)2], 0,30mol de ácido clorídrico (HCl), 0,20mol de cloreto de cálcio (CaCl2) e diluindo para 1,00 litro. Marque a alternativa que melhor apresenta as concentrações de cada íon na solução.
- A. [Ca2+] = 0,20mol/L; [H3O+ ] = 0,30mol/L; [NO3- ] = 0,20mol/L; [Cl- ] = 0,50mol/L.
- B. [Ca2+] = 0,20mol/L; [H3O+ ] = 0,30mol/L; [NO3- ] = 0,10mol/L; [Cl- ] = 0,70mol/L.
- C. [Ca2+] = 0,30mol/L; [H3O+ ] = 0,30mol/L; [NO3- ] = 0,10mol/L; [Cl- ] = 0,50mol/L.
- D. [Ca2+] = 0,30mol/L; [H3O+ ] = 0,30mol/L; [NO3- ] = 0,20mol/L; [Cl- ] = 0,70mol/L.
As titulações argentimétricas são largamente utilizadas e baseiam-se na titulação com íons Ag+. Uma amostra de solução salina foi analisada para determinar o teor em cloreto. Uma amostra de 20,00mL de solução foi tratada com 12,000mL de uma solução padrão de AgNO3 0,1324 M. Depois, o excesso de prata foi titulado com uma solução padrão de KSCN 0,1200 M, sendo necessário 1,400mL para atingir o ponto de equivalência de Fe(SCN)2+. Calcule a concentração de cloreto na solução salina, em g/L.
- A. 0,0710mol . L-1
- B. 0,1680mol . L-1
- C. 1,4208mol . L-1
- D. 1,5888mol . L-1


