Questões sobre Sistemas de equilíbrio
Lista completa de Questões sobre Sistemas de equilíbrio para resolução totalmente grátis. Selecione os assuntos no filtro de questões e comece a resolver exercícios.
Química - Sistemas de equilíbrio - Intituto de Desenvolvimento Educacional, Cultural e Assistencial Nacional (IDECAN) - 2017
A ebulição, o congelamento e a conversão da grafita em diamante são exemplos de transições de fase, ou mudanças de fase sem mudança de composição química. Muitas mudanças de fase são fenômenos cotidianos comuns e a sua descrição é importante. Elas ocorrem quando um sólido se transforma num líquido, como na fusão do gelo, ou um líquido se transforma num vapor, como na vaporização da água em nossos pulmões. Sobre as transformações físicas, analise as afirmativas a seguir.
I. O hélio tem comportamento pouco comum nas temperaturas baixas. As fases sólida e vapor nunca estão em equilíbrio. O hélio sólido pode ser obtido, mas somente quando os átomos são forçados a se manterem juntos pela aplicação de uma pressão externa.
II. No equilíbrio, o potencial químico de uma substância é o mesmo em toda a amostra, qualquer que seja o número de fases presentes.
III. Uma diminuição de pressão eleva o potencial químico de qualquer substância pura, pois Vm > 0.
Está(ão) correta(s) apenas a(s) afirmativa(s)
- A. III.
- B. I e II.
- C. I e III.
- D. II e III.
Química - Sistemas de equilíbrio - Intituto de Desenvolvimento Educacional, Cultural e Assistencial Nacional (IDECAN) - 2017
Uma pedra de gelo a 0°C de massa desconhecida foi colocada em um recipiente contendo 100 g de água a 24°C. Considerando que não houve troca de calor com o meio externo e que ao atingir o equilíbrio térmico ainda restaram 40 g de gelo, então a massa de gelo colocada inicialmente no recipiente era de: (Considere: calor específico da água = 1,0 cal/g°C; calor latente de fusão do gelo = 80 cal/g.)
- A. 60 g.
- B. 70 g.
- C. 80 g.
- D. 90 g.
Com base nos conceitos de equilíbrio químico, julgue os itens subsequentes. O equilíbrio químico ocorre quando há um equilíbrio dinâmico entre reagentes e produtos em uma reação química, ou seja, a condição na qual os processos direto e inverso ocorrem simultaneamente em velocidades iguais.
- C. Certo
- E. Errado
Muitas reações químicas não cessam, mas apenas entram em equilíbrio, ou seja, continuam acontecendo microscopicamente, embora não se perceba macroscopicamente. Outras reações acontecem constantemente, mas de forma muito lenta. A respeito desses fatos, julgue os itens que se seguem. O estado de equilíbrio da reação de uma pilha recarregável é deslocado pela passagem de corrente elétrica.
- C. Certo
- E. Errado
Muitas reações químicas não cessam, mas apenas entram em equilíbrio, ou seja, continuam acontecendo microscopicamente, embora não se perceba macroscopicamente. Outras reações acontecem constantemente, mas de forma muito lenta. A respeito desses fatos, julgue os itens que se seguem. A relação entre as concentrações das espécies participantes de um equilíbrio químico pode ser expressa matematicamente por meio de uma equação que considera a concentração de cada espécie, independentemente de seu estado físico.
- C. Certo
- E. Errado
Em 1923, o químico dinamarquês Johannes Brønsted (1879-1947) e o químico inglês Thomas Lowry (1874-1936) propuseram uma definição de ácidos e bases mais geral do que a proposta anteriormente por Arrhenius (1859-1927). O conceito de Brønsted- Lowry está baseado no fato de que a reação ácido-base envolve transferência de íons H+ de uma substância para outra.
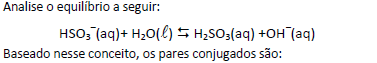
- A.

- B.

- C.

- D.

- E.

Sobre equilíbrio químico, NÃO é correto afirmar que:
- A. Quando a constante de equilíbrio (Kc) é maior do que 1, a concentração dos produtos no equilíbrio é maior do que a dos reagentes.
- B. No equilíbrio, a velocidade da reação direta é maior do que a da reação inversa.
- C. Variações de temperatura e pressão podem deslocar o equilíbrio.
- D. A constante de equilíbrio independe das concentrações iniciais dos reagentes.
- E. No equilíbrio, a concentração de cada substância do sistema permanece constante.
Química - Sistemas de equilíbrio - FUNRIO Fundação de Apoio a Pesquisa, Ensino e Assistência (FUNRIO) - 2014
Com relação ao número de fases, os sistemas podem ser classificados como homogêneos ou heterogêneos. Assinale a alternativa que NÃO correlaciona adequadamente o sistema e sua classificação, respectivamente.
- A. Água e óleo heterogêneo.
- B. Água do mar filtrada homogêneo.
- C. Leite homogêneo.
- D. Gasolina e água homogêneo.
- E. Água e areia homogêneo.
Considere os seguintes sistemas:
I. Água e óleo II. Ácido sulfúrico III. Gás nitrogênio IV. Água e cloreto de potássio Em relação às características desses sistemas, é INCORRETO afirmar que:- A. O sistema I possui apenas uma fase.
- B. Os sistemas I e III são, respectivamente, mistura heterogênea e substância simples.
- C. O sistema II representa uma substância composta.
- D. Os sistemas II e III são substâncias puras.
O INPI recebeu o pedido de patente de uma formulação líquida emulsionada de uso cosmético cujo componente ativo é um óleo fixo natural, recém-isolado pelos pesquisadores, com propriedades hidratantes para a pele. Os autores afirmam que a formulação é bastante estável e que, além do óleo, ela apresenta uma porcentagem relativamente alta (40% v/v) de tensoativo e cotensoativo não iônicos.
Com referência a essa situação hipotética, julgue os itens a seguir.
Considerando-se que o sistema tensoativo selecionado para a estabilização da emulsão apresente um equilíbrio hidrófilo-lipófilo (EHL) alto, a emulsão desenvolvida será do tipo água-em-óleo.- C. Certo
- E. Errado


