Questões sobre Soluções e Substâncias Inorgânicas
Lista completa de Questões sobre Soluções e Substâncias Inorgânicas para resolução totalmente grátis. Selecione os assuntos no filtro de questões e comece a resolver exercícios.
Química - Soluções e Substâncias Inorgânicas - Centro de Seleção e de Promoção de Eventos UnB (CESPE) - 2020
-
A) 15 mL da solução de cloreto de sódio 0,5 mol/L e completar com água o volume até atingir os 100 mL.
B) 30 mL da solução de cloreto de sódio 0,5 mol/L e adicionar 100 mL de água.
C) 60 mL de água e completar o volume com 40 mL da solução de cloreto de sódio 0,5 mol/L.
D) 30 mL da solução de cloreto de sódio 0,5 mol/L e completar com água o volume até atingir os 100 mL.
E) 50 mL da solução de cloreto de sódio 0,5 mol/L e completar com água o volume até atingir os 100 mL.
Os métodos potenciométricos de análises se baseiam na medida do potencial de células eletroquímicas, sem o consumo apreciável de corrente. Há cerca de um século, as técnicas potenciométricas têm sido utilizadas para localizar o ponto final em titulações.
Considere que em uma titulação potenciométrica de 10 mL de ácido clorídrico (HCl), a partir de um padrão de NaOH 0,10 mol/L, os resultados experimentais foram estimados utilizando o método da primeira derivada, conforme descrito no gráfico a seguir.
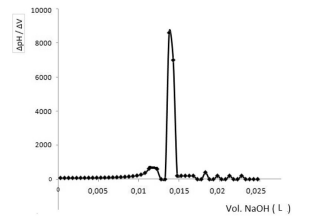
Nesse contexto, a concentração de ácido clorídrico em mol/L titulado por hidróxido de sódio é igual a
-
A) 0,10.
B) 0,13.
C) 0,20.
D) 0,25.
Analise a situação a seguir.
Em um preparo de 100 mL de uma solução de ácido clorídrico (HCl) 0,1 mol/L, um técnico retirou da solução estoque 1 mL e completou com água até a linha de aferição.
Considerando que a densidade da solução estoque era 1,1 g/mL, qual a porcentagem aproximada em massa do ácido que estava contida no estoque?
-
A) 33,2.
B) 20,1.
C) 10,0.
D) 0,36.
A formação de complexos é usada de muitas maneiras em Química Analítica . A análise química nessa área pode ser utilizada, por exemplo, para medir a quantidade de um analito, para controlar a quantidade efetiva deste que está disponível para outras reações ou como ferramenta para separação de substâncias químicas.
Considerando esse contexto, avalie as seguintes afirmativas e a relação proposta entre elas.
I. A formação de complexos é uma reação na qual ocorre uma ligação reversível entre duas ou mais espécies químicas distintas, como por exemplo, a amônia e Cu2+,
POR QUE
II. nesse caso o NH3 fornece um par de elétrons para os orbitais externos de um íon Cu2+, formando um complexo entre a amônia e o íon metálico, característico de uma reação ácido-base de Lewis.
A respeito dessas afirmativas e da relação proposta entre elas, assinale a alternativa correta.
-
A) As afirmativas I e II são verdadeiras, e a II é uma justificativa da I.
B) As afirmativas I e II são verdadeiras, mas a II não é uma justificativa da I.
C) A afirmativa I é verdadeira, e a II é falsa.
D) A afirmativa I é falsa, e a II é verdadeira.
Considere que em uma amostra de água fluvial foi analisada a concentração de Fe+2 por meio da titulação redox. Para isso retirou-se uma alíquota de 50 mL da amostra da água, que foi titulada com uma solução-padrão de KMnO4 0,10 mol/L em meio ácido.
Se 20 mL da solução de permanganato são necessários para atingir o ponto final da titulação, a concentração de íon ferro (II), em mol/L, na água fluvial, é igual a
-
A) 0,04.
B) 0,10.
C) 0,20.
D) 0,40.
-
A) Solução eletrolítica.
B) Solução não eletrolítica.
C) Solução acuosa.
D) Solução iônica.
E) Solução catiônica.
-
A) hematoxilina, azul de metileno, azul de toluidina, azul de alcian e fucsina.
B) hematoxilina, xylidine ponceau, azul de toluidina, azul de alcian e fucsina.
C) hematoxilina, azul de metileno, floxina, azul de alcian e fucsina.
D) hematoxilina, azul de metileno, azul de toluidina, azul de anilina e fucsina.
E) hematoxilina, azul de metileno, azul de toluidina, azul de alcian e verde luz.
m = 20/ (152g.mol).(1.0) m = 0,13
-
A) 0,152.
B) 0,13.
C) 15.
D) 131,57.
E) 20.


