Questões de Engenharia Química da FUNDATEC Processos Seletivos (FUNDATEC)
Lista completa de Questões de Engenharia Química da FUNDATEC Processos Seletivos (FUNDATEC) para resolução totalmente grátis. Selecione os assuntos no filtro de questões e comece a resolver exercícios.
Em um laboratório de análise química, há três tambores plásticos (X, Y e Z) destinados ao descarte de soluções e nos seus rótulos se lê os seguintes dizeres:

Considerando que o correto descarte tenha sido feito pelo perito, assinale a alternativa correta.
- A. A solução 3 foi descartada no tambor Y já que, em solução, a glicose apresenta caráter alcalino.
- B. A solução 2 foi descartada no tambor X, pois a solução de hidróxido de sódio, no volume e na concentração empregados, não eram capazes de neutralizar completamente a solução de ácido clorídrico.
- C. As três soluções foram descartadas no tambor Z já que todas apresentam pH=7.
- D. Por ser proveniente de base forte, a solução 1 foi descartada no tambor Y.
- E. A solução 2 poderia ser corretamente descartada no tambor Z se tivesse sido preparada a partir de 50 mL de ácido clorídrico de concentração 0,1 mol/L adicionado a 20 mL de uma solução aquosa hidróxido de sódio, de concentração 0,5 mol/L.
 Considerando o que foi apresentado, assinale a alternativa correta.
Considerando o que foi apresentado, assinale a alternativa correta.
- A. A massa de cocaína contida em 5.000 tubos era de 225g.
- B. A densidade do pó contido em cada tubo era de 0,33 g/mL.
- C. A massa da totalidade dos tubos (10.000 tubos), após a remoção da totalidade do pó, era de 5.000g.
- D. A massa de pó apreendida que não correspondia à cocaína era de 4.750g.
- E. A densidade do pó contido em cada tubo era de 1,0 g/mL.
 A quantidade de cocaína presente em um único tubo era de:
A quantidade de cocaína presente em um único tubo era de:
- A. 2,5 mg.
- B. 5,0 mg.
- C. 25 mg.
- D. 50 mg.
- E. 500 mg.
Zezinho é um perito que foi encarregado de analisar, por meio de cromatografia gasosa acoplada à espectrometria de massas (com ionização por impacto de elétrons), um lote de padrões analíticos das moléculas abaixo listadas:
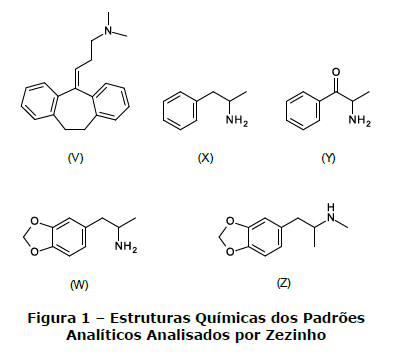
No entanto, antes das análises e na tentativa de prever qual seria o perfil de fragmentação de cada uma dessas moléculas, Zezinho formulou cinco hipóteses, dentre as quais, assinale a única que se mostrará correta.
- A. As moléculas V, X e Z apresentarão em comum um fragmento com m/z = 58, originário de fragmentação comumente observada em aminas.
- B. As moléculas X e Y apresentarão um mesmo fragmento de m/z = 44, originário de fragmentação comumente observada em aminas.
- C. As moléculas W e Z, por se tratarem de isômeros de posição, apresentarão espectros semelhantes.
- D. A molécula Z não apresentará fragmento com m/z que possa ser encontrado em pelo menos uma das demais estruturas analisadas.
- E. Todas as aminas primárias analisadas apresentarão um fragmento comum de m/z = 58.
Álcoois são de grande versatilidade do ponto de vista sintético, pois podem participar de uma série de reações. Exemplos dessa versatilidade são mostrados nas reações não balanceadas nas quais apenas o produto principal é mostrado:
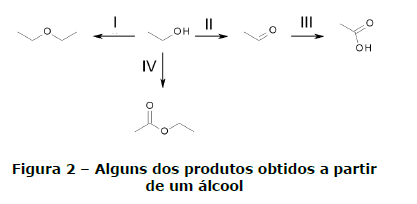
Sobre essa reação e os compostos nela envolvidos, assinale a alternativa INCORRETA.
- A. Em I ocorre uma desidratação intermolecular. Se essa desidratação fosse intramolecular, o produto seria um alceno.
- B. Os produtos das reações I e IV são mais apolares do que os reagentes.
- C. Os produtos das reações de oxidação II e III apresentam carbono sp2 e carbono sp3.
- D. O produto da reação III, quando adicionado à água com pOH maior do que 7, encontrarse- á mais ionizado do que em água com pOH menor do que 7.
- E. A combustão completa tanto do reagente quanto dos produtos mostrados em I, II, III e IV formará gás carbônico e água.
Considerando a reação de combustão do metano (CH4(g)), é correto afirmar que se trata de um processo termoquímico:
- A. Endotérmico, com liberação de energia e ΔH<0.
- B. Exotérmico, com liberação de energia e ΔH<0.
- C. Exotérmico, com liberação de energia e ΔH >0.
- D. Endotérmico, com absorção de energia e ΔH>0.
- E. Exotérmico, com absorção de energia e ΔH<0.
Considere os seguintes tipos de materiais vegetais:
Folhas de coca (Erythroxylum coca), das quais se extraem o alcalóide cocaína (observação: comporta-se como base fraca).
Folhas de maconha (Cannabis sativa) das quais se obtém diferentes canabinóides, dentre os quais, o delta-9 tetraidrocanabinol (delta-9 THC), molécula de baixa hidrossolubilidade.
Para a extração dos princípios ativos desses materiais vegetais, um laboratório forense dispõe dos seguintes sistemas de solventes para extração:
I. Clorofórmio acrescido de ácido acético glacial (H3C-COOH).
II. Clorofórmio (CHCl3) acrescido de hidróxido de amônio.
III. Clorofórmio puro (CHCl3).
IV. Tolueno (hidrocarboneto aromático de fórmula: C7H8). V. Solução aquosa 10-5 mol/L de ácido clorídrico.
VI. Solução aquosa 10-5 mol/L de hidróxido de sódio.
VII. Água pura.
Considerando que os sistemas de solventes já foram exaustivamente testados e que não causarão degradação dos princípios ativos e que os protocolos de extração do laboratório preveem o uso sempre da mesma quantidade de material vegetal e de solventes (todos em temperatura ambiente) para todas as metodologias de extração, assinale a alternativa INCORRETA.
- A. A extração das folhas de coca com o sistema VII será mais efetiva do que com o sistema V.
- B. A extração da cocaína será mais eficiente com o sistema II do que com I.
- C. O sistema IV é recomendado para a extração de delta 9-THC já que este apresenta baixa polaridade, tal qual o tolueno.
- D. Ao usar o sistema I, a cocaína estará em uma forma mais polar do que estaria se o sistema empregado fosse o II.
- E. Dentre os sistemas disponíveis no laboratório, não são os mais recomendados para extração do delta-9-THC: V, VI e VII.
Um perito resolveu usar o cloreto de etila (I) como modelo de estrutura química para testar um software de previsão de espectros de Ressonância Magnética Nuclear de 1H. A partir dessa molécula, foram feitas substituições que originaram outros compostos similares (II, III, IV, V e VI), que também foram testados.
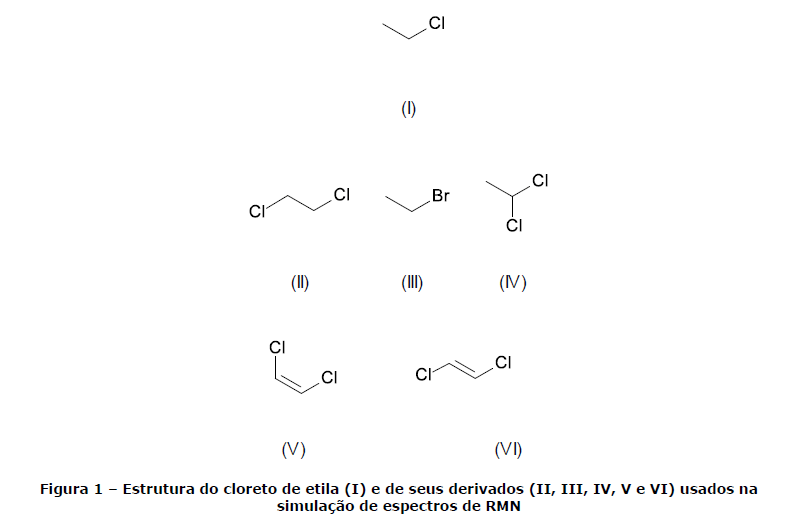
Os testes do software não incluíam sobreposição de espectros de solventes, nem de agentes como o TMS. Considerando as moléculas e as observações teóricas feitas pelo perito, assinale a alternativa INCORRETA.
- A. O espectro observado do cloreto de etila (I) apresentava um quarteto e um tripleto.
- B. Ao substituir um dos átomos de hidrogênio do carbono inicialmente não halogenado por um átomo de cloro (II), o perito observou um singleto.
- C. Ao trocar o átomo de cloro na molécula do cloreto de etila (I) por um de bromo (formando III), o perito observou que o sinal referente aos hidrogênios do carbono halogenado se deslocou no sentido do campo mais alto.
- D. A substituição de um dos átomos de hidrogênio do carbono inicialmente halogenado por um átomo de cloro (originando IV) fez com que o perito observasse um dubleto e um quarteto.
- E. A partir do cloreto de etila, a introdução de uma dupla ligação entre os átomos de carbono e a substituição de um dos átomos de hidrogênio do carbono não halogenado por cloro poderia originar dois isômeros: um cis (V) e outro trans (VI), cujos espectros apresentaram multiplicidades diferentes.
Em relação a um ciclo consistindo em uma pressão constante, um volume constante e dois processos isentrópicos, analise as assertivas abaixo:
I. Ciclo de Carnot.
II. Ciclo de Stirling.
III. Ciclo Otto.
IV. Ciclo Diesel.
Quais estão corretas?
- A. Apenas I.
- B. Apenas IV.
- C. Apenas II e III.
- D. Apenas I, II e III.
- E. I, II, III e IV.
Qual das seguintes medidas aumentará o volume de um gás real por quatro vezes?
- A. Duplicando a temperatura absoluta, bem como a pressão do gás.
- B. Duplicando a pressão absoluta, mas não alterando a temperatura.
- C. Reduzindo a pressão para um quarto à temperatura constante.
- D. Reduzindo a temperatura para um quarto à pressão constante.
- E. Reduzindo a temperatura para metade e dobrando a pressão.


