Questões de Química do ano 2020
Lista completa de Questões de Química do ano 2020 para resolução totalmente grátis. Selecione os assuntos no filtro de questões e comece a resolver exercícios.
Considere que um estudante misturou 20 mL de uma solução aquosa de HCl 1,0 mol/L com 20 mL de uma solução aquosa de NaOH 1,0 mol/L em um calorímetro. A temperatura da mistura reacional aumentou de 20 ºC para 28 ºC.
Partindo do princípio que a perda de calor da mistura reacional para o ambiente é desprezível e que o volume total da mistura é 40 mL, é correto afirmar que a variação da entalpia da reação é mais próxima de
Dados:
Calor específico (c) do meio reacional é igual a 4,18 J/g K.
Densidade (d) da mistura é igual a 1,0 g/mL.
-
A) 1,3 kJ/mol.
B) 6,5 kJ/mol.
C) 65 kJ/mol.
D) 130 kJ/mol.
O termo cromatografia é difícil de ser definido rigorosamente porque o nome tem sido aplicado a diversos sistemas e técnicas. Todos esses métodos, contudo, apresentam em comum o uso de uma fase estacionária e de uma fase móvel. A cromatografia gasosa é uma das técnicas mais empregadas em análises qualitativas e quantitativas. Sobre a cromatografia gasosa, assinale com V as afirmativas verdadeiras e com F as falsas.
( ) A cromatografia gáslíquido é baseada na partição do analito entre a fase móvel gasosa e uma fase líquida imobilizada na superfície de um material sólido inerte de recheio ou nas paredes de um tubo capilar.
( ) A fase móvel em cromatografia gasosa é denominada gás de arraste e deve ser quimicamente reativa com o analito de interesse.
( ) O sistema de configuração de colunas é composto por seringas calibradas empregadas para configurar o fluxo de gás de arraste e substâncias imóveis.
( ) Nas separações cromatográficas gasosas, dezenas de detectores podem ser empregados, mas o detector de ionização em chama (DIC) é o mais empregado em aplicações da cromatografia gasosa em geral.
Assinale a sequência correta.
-
A) V F F V
B) V V F F
C) F V V F
D) F F V V
A lei de absorção, também conhecida como Lei de Beer, diz quantitativamente como a grandeza da atenuação depende da concentração das moléculas absorventes e da extensão do caminho sobre o qual ocorre a absorção. A transmitância T da solução é a fração da radiação incidente transmitida pela solução.
Considerando que um feixe de radiação, ao passar por uma solução absorvente, registrou uma absorbância X, é correto afirmar que a transmitância será igual a
-
A) X/10.
B) X10.
C) 1/10X.
D) 10X.
Considere que em uma amostra de água fluvial foi analisada a concentração de Fe+2 por meio da titulação redox. Para isso retirou-se uma alíquota de 50 mL da amostra da água, que foi titulada com uma solução-padrão de KMnO4 0,10 mol/L em meio ácido.
Se 20 mL da solução de permanganato são necessários para atingir o ponto final da titulação, a concentração de íon ferro (II), em mol/L, na água fluvial, é igual a
-
A) 0,04.
B) 0,10.
C) 0,20.
D) 0,40.
-
A) Solução eletrolítica.
B) Solução não eletrolítica.
C) Solução acuosa.
D) Solução iônica.
E) Solução catiônica.
-
A) hematoxilina, azul de metileno, azul de toluidina, azul de alcian e fucsina.
B) hematoxilina, xylidine ponceau, azul de toluidina, azul de alcian e fucsina.
C) hematoxilina, azul de metileno, floxina, azul de alcian e fucsina.
D) hematoxilina, azul de metileno, azul de toluidina, azul de anilina e fucsina.
E) hematoxilina, azul de metileno, azul de toluidina, azul de alcian e verde luz.
Qual tipo de isomeria a figura representa?
-
A) Função.
B) Posição.
C) Compensação.
D) Tautomeria.
E) Cadeia.
-
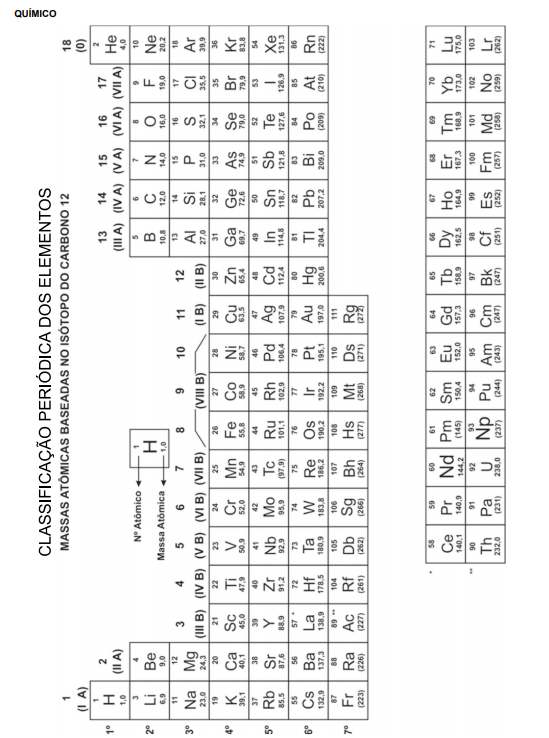
A) metais alcalinos terrosos.
B) não metais.
C) semimetais.
D) metais alcalinos.
E) metais de transição.
m = 20/ (152g.mol).(1.0) m = 0,13
-
A) 0,152.
B) 0,13.
C) 15.
D) 131,57.
E) 20.
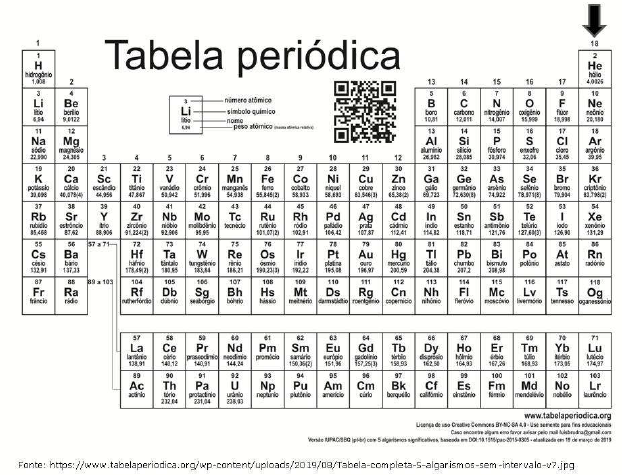
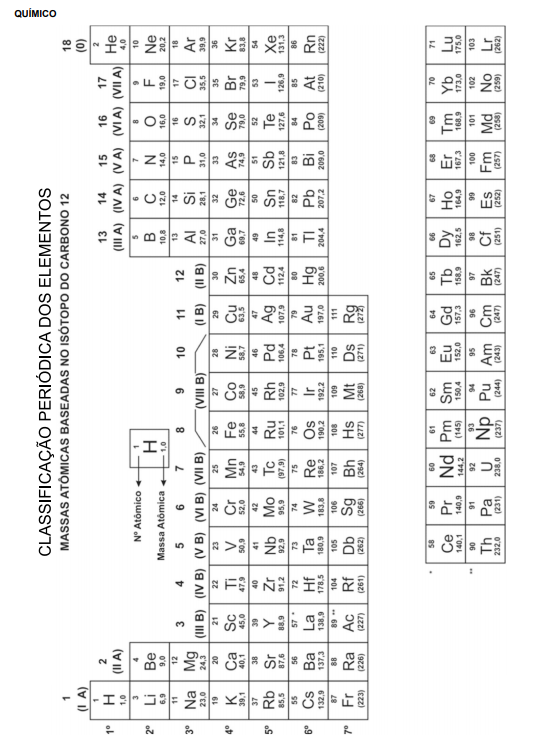
-
A) Metais.
B) Gases nobres.
C) Semimetais.
D) Ametais.
E) Metais alcalinos.


