Questões de Química
Lista completa de Questões de Química para resolução totalmente grátis. Selecione os assuntos no filtro de questões e comece a resolver exercícios.
A lei de absorção, também conhecida como Lei de Beer, diz quantitativamente como a grandeza da atenuação depende da concentração das moléculas absorventes e da extensão do caminho sobre o qual ocorre a absorção. A transmitância T da solução é a fração da radiação incidente transmitida pela solução.
Considerando que um feixe de radiação, ao passar por uma solução absorvente, registrou uma absorbância X, é correto afirmar que a transmitância será igual a
-
A) X/10.
B) X10.
C) 1/10X.
D) 10X.
O termo cromatografia é difícil de ser definido rigorosamente porque o nome tem sido aplicado a diversos sistemas e técnicas. Todos esses métodos, contudo, apresentam em comum o uso de uma fase estacionária e de uma fase móvel. A cromatografia gasosa é uma das técnicas mais empregadas em análises qualitativas e quantitativas. Sobre a cromatografia gasosa, assinale com V as afirmativas verdadeiras e com F as falsas.
( ) A cromatografia gáslíquido é baseada na partição do analito entre a fase móvel gasosa e uma fase líquida imobilizada na superfície de um material sólido inerte de recheio ou nas paredes de um tubo capilar.
( ) A fase móvel em cromatografia gasosa é denominada gás de arraste e deve ser quimicamente reativa com o analito de interesse.
( ) O sistema de configuração de colunas é composto por seringas calibradas empregadas para configurar o fluxo de gás de arraste e substâncias imóveis.
( ) Nas separações cromatográficas gasosas, dezenas de detectores podem ser empregados, mas o detector de ionização em chama (DIC) é o mais empregado em aplicações da cromatografia gasosa em geral.
Assinale a sequência correta.
-
A) V F F V
B) V V F F
C) F V V F
D) F F V V
Considere que um estudante misturou 20 mL de uma solução aquosa de HCl 1,0 mol/L com 20 mL de uma solução aquosa de NaOH 1,0 mol/L em um calorímetro. A temperatura da mistura reacional aumentou de 20 ºC para 28 ºC.
Partindo do princípio que a perda de calor da mistura reacional para o ambiente é desprezível e que o volume total da mistura é 40 mL, é correto afirmar que a variação da entalpia da reação é mais próxima de
Dados:
Calor específico (c) do meio reacional é igual a 4,18 J/g K.
Densidade (d) da mistura é igual a 1,0 g/mL.
-
A) 1,3 kJ/mol.
B) 6,5 kJ/mol.
C) 65 kJ/mol.
D) 130 kJ/mol.
As características químicas da água ocorrem em função da presença de substâncias dissolvidas, geralmente mensuráveis apenas por meios analíticos.
Relacione a COLUNA II com a COLUNA I associando os indicadores químicos das águas às suas propriedades.
COLUNA I
1. Dureza
2. Alcalinidade
3. Corrosividade
4. Salinidade
COLUNA II
( ) Indicador caracterizado pela presença de ácidos minerais ou soluções de oxigênio que atuam sobre os metais.
( ) Característica conferida à água pela presença de sais de metais alcalino-terrosos e alguns outros metais em menor quantidade.
( ) Presença na água de substâncias como bicarbonatos, cloretos e sulfatos, conferindo a ela um sabor característico.
( ) Característica decorrente da presença de bicarbonatos, carbonatos e hidróxidos, quase sempre de metais alcalinos ou alcalino-terrosos.
Assinale a sequência correta.
-
A) 2 3 1 4
B) 3 1 4 2
C) 1 4 2 3
D) 4 2 3 1
Em análises químicas, os erros sistemáticos têm um valor definido e uma causa justificável, sendo da mesma ordem de grandeza para réplicas de medidas realizadas de maneira semelhante. Existem três tipos de erros sistemáticos: instrumentais, no método e do operador.
Entre os exemplos a seguir, aquele que é considerado um erro instrumental é:
-
A) Aferir incorretamente o nível de um líquido na escala da bureta.
B) Escolha equivocada de um reagente ácido para abertura de amostra.
C) Calibrar equivocadamente um pHmetro.
D) Influência da tensão elétrica na sensibilidade de um equipamento.
A formação de complexos é usada de muitas maneiras em Química Analítica . A análise química nessa área pode ser utilizada, por exemplo, para medir a quantidade de um analito, para controlar a quantidade efetiva deste que está disponível para outras reações ou como ferramenta para separação de substâncias químicas.
Considerando esse contexto, avalie as seguintes afirmativas e a relação proposta entre elas.
I. A formação de complexos é uma reação na qual ocorre uma ligação reversível entre duas ou mais espécies químicas distintas, como por exemplo, a amônia e Cu2+,
POR QUE
II. nesse caso o NH3 fornece um par de elétrons para os orbitais externos de um íon Cu2+, formando um complexo entre a amônia e o íon metálico, característico de uma reação ácido-base de Lewis.
A respeito dessas afirmativas e da relação proposta entre elas, assinale a alternativa correta.
-
A) As afirmativas I e II são verdadeiras, e a II é uma justificativa da I.
B) As afirmativas I e II são verdadeiras, mas a II não é uma justificativa da I.
C) A afirmativa I é verdadeira, e a II é falsa.
D) A afirmativa I é falsa, e a II é verdadeira.
Química - Radioatividade: Reações de Fissão e Fusão Nuclear, Desintegração Radioativa e Radioisótopos. - FUNDEP (Gestão de Concursos) - 2020
Uma série natural de decaimento radioativo começa com uma espécie radioativa que, ao emitir radiações alfa, beta e / ou gama, forma uma espécie mais estável.
Considere que um mol de um elemento radiativo emitiu sete mols de partículas alfa e quatro mols de partículas beta produzindo um mol de um elemento mais estável.
Nesse contexto, qual processo reacional nuclear pode representar esse decaimento radioativo?
-
A) Urânio-238 é transformado em rádio-226.
B) Urânio-238 é transformado em astato-210.
C) Urânio-235 é transformado em chumbo-207.
D) Urânio-235 é transformado em polônio-209.
Analise a situação a seguir.
Em um preparo de 100 mL de uma solução de ácido clorídrico (HCl) 0,1 mol/L, um técnico retirou da solução estoque 1 mL e completou com água até a linha de aferição.
Considerando que a densidade da solução estoque era 1,1 g/mL, qual a porcentagem aproximada em massa do ácido que estava contida no estoque?
-
A) 33,2.
B) 20,1.
C) 10,0.
D) 0,36.
Na área de estudo da potenciometria, sabe-se que o eletrodo indicador é um dispositivo que, imerso na solução contendo o analito, desenvolve um potencial, que depende da atividade do analito. A maioria dos eletrodos indicadores empregados na potenciometria é seletiva em sua resposta.
Um eletrodo que é classificado como eletrodo indicador é o
-
A) metálico de cobre.
B) de prata/cloreto de prata.
C) de calomelano.
D) padrão de hidrogênio.
A Aspirina, como é conhecida o ácido acetilsalicílico (C9H8O4), é um fármaco que apresenta propriedades antitérmicas, anti-inflamatórias e analgésicas. Esse fármaco pode ser sintetizado pela reação entre o ácido salicílico (C7H6O3) e o anidrido acético (C4H6O3), catalisada por um ácido.
A equação a seguir representa o processo de síntese da aspirina.
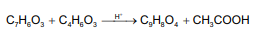
Considere, hipoteticamente, que 3 g de ácido salicílico foram misturados com 6 mL de uma solução de anidrido acético cuja densidade e grau de pureza são 1,2 g/mL e 80% m/m, respectivamente.
Se o rendimento da reação química é 100%, qual a massa aproximada de aspirina produzida em gramas?
-
A) 2.
B) 4.
C) 8.
D) 16.


