Questões de Química
Lista completa de Questões de Química para resolução totalmente grátis. Selecione os assuntos no filtro de questões e comece a resolver exercícios.
Considerada como técnica analítica bem-sucedida, a espectrometria de absorção atômica é uma das mais utilizadas na determinação de elementos em baixas concentrações, que estão presentes em uma variedade de amostras, líquidas, sólidas, em suspensão ou até mesmo gasosas.
Sobre a técnica de espectrometria de absorção atômica, assinale com V as afirmativas verdadeiras e com F as falsas.
( ) A técnica de absorção atômica pode ser aplicada para quantificar vários elementos ao mesmo tempo.
( ) Instrumentos de absorção atômica utilizam um plasma de alta temperatura para atomização e excitação da amostra.
( ) A determinação de espécies atômicas somente é feita em meio gasoso, no qual os átomos individuais ou íons elementares se encontram bem espaçados uns dos outros.
( ) As análises quantitativas pela técnica de absorção atômica são baseadas em calibração com padrões externos e não devem ser fundamentadas na medida de um único padrão, presumindo que a Lei de Beer esteja sendo obedecida.
Assinale a sequência correta.
-
A) V V F F
B) F F V V
C) F V V F
D) V F F V
Os métodos potenciométricos de análises se baseiam na medida do potencial de células eletroquímicas, sem o consumo apreciável de corrente. Há cerca de um século, as técnicas potenciométricas têm sido utilizadas para localizar o ponto final em titulações.
Considere que em uma titulação potenciométrica de 10 mL de ácido clorídrico (HCl), a partir de um padrão de NaOH 0,10 mol/L, os resultados experimentais foram estimados utilizando o método da primeira derivada, conforme descrito no gráfico a seguir.
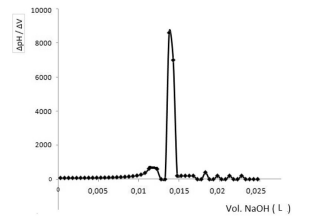
Nesse contexto, a concentração de ácido clorídrico em mol/L titulado por hidróxido de sódio é igual a
-
A) 0,10.
B) 0,13.
C) 0,20.
D) 0,25.
As propriedades das substâncias aumentam sua magnitude de acordo com os tipos de interações entre moléculas predominantes.
Nesse sentido, é correto afirmar que as forças intermoleculares são fortes quando se têm menores
-
A) temperaturas de ebulição.
B) viscosidades.
C) pressões de vapor.
D) tensões superficiais.
Analise a situação a seguir.
Em um experimento de Química Geral, um estudante misturou 1 mL de uma solução aquosa de nitrato de chumbo (Pb(NO3 )2 ) 0,2 mol/L com 10 mL de uma solução aquosa de iodeto de potássio (KI) 0,05 mol/L.
Considerando que o experimento foi realizado a certa temperatura, em que o Kps do iodeto de chumbo (PbI2 ) é igual a 1 x 108, quanto em porcentagem da massa total do iodeto de chumbo ficou solúvel na mistura?
-
A) 94.
B) 20.
C) 0,6.
D) 0,2.
I- O ácido cianídrico pode ser utilizado como catalizador da reação. II- O mecanismo de reação pode ser descrito pela protonação do ácido acético, seguido de um ataque nucleofílico e pela eliminação de uma molécula de água. III- O mecanismo de reação pode ser descrito pela protonação do ácido acético, seguido de um ataque eletrofílico e pela eliminação de uma molécula de água.
É correto o que se afirma em:
-
A) I, apenas.
B) I, II e III.
C) II, apenas.
D) I e II, apenas.
E) III, apenas.
-
A) Os elétrons fluem do eletrodo de menor potencial de oxidação para o de maior potencial de oxidação.
B) No polo negativo, ocorre a oxidação do cobre.
C) No polo positivo, ocorre a redução do zinco.
D) Os elétrons fluem do eletrodo de maior potencial de oxidação para o de menor potencial de oxidação.
E) O eletrodo de zinco aumenta de massa.
Experimento [NH3] (mol L-1 ) [HNO3] (mol L-1 ) Velocidade da reação (mol L-1 s -1 ) 1 0,02 0,04 2.10-4 2 0,02 0,08 4.10-4 3 0,04 0,04 8.10-4
Baseado nos dados cinéticos, afirma-se:
I- A reação é de ordem 1 para o ácido nítrico. II- A reação é de ordem 2 para a amônia. III- A unidade da constante de velocidade é (mol L-1 ) s-1 .
É correto o que se afirma em:
-
A) I, apenas.
B) II, apenas.
C) III, apenas.
D) I, II e III.
E) I e II, apenas.
I- Os valores de ka e pKa não podem ser utilizados de forma quantitativa, somente qualitativa. II- De maneira genérica, a constante de dissociação de um ácido em água pode ser escrita como Ka = ([A- ] [H3O+ ]) / ([HA] [H2O]). III- Quanto maior o valor de Ka, maior é a força do ácido.
É correto o que se afirma em:
-
A) III, apenas.
B) II, apenas.
C) II e III, apenas.
D) I, II e III.
E) I, apenas.
3 Cuo(s) + 8 HNO3(aq) ? 3 Cu(NO3)2(aq) + 2 NO(g) + 4 H2O(l) (1) 2 NO(g) + O2(g) ? 2 NO2(g) (2) NO2(g) ? N2O4(g) (3)
Isso posto, considerando um sistema transparente e fechado, o produto NO2(g) apresenta coloração marrom. O produto N2O4(g) é um gás incolor e, quando o sistema é aquecido acima da temperatura ambiente, o sistema apresenta uma coloração marrom (forte). Em relação à equação três, referente à formação do N2O4(g), é correto afirmar que:
-
A) Em um sistema adiabático, o aumento da pressão do sistema com um gás inerte desloca o equilíbrio químico na direção da formação dos reagentes.
B) Em um sistema adiabático, o aumento da temperatura da vizinhança desloca o equilíbrio químico no sentido da formação dos produtos.
C) O aumento da temperatura do sistema desloca o equilíbrio químico no sentido de formação do produto.
D) No equilíbrio químico, o sistema apresentará uma coloração incolor.
E) Em um sistema adiabático, o aumento da pressão do sistema com um gás inerte desloca o equilíbrio químico na direção da formação do produto.
A respeito de um sistema adiabático, são dadas as seguintes sentenças:
I- A temperatura no interior do sistema adiabático é constante.
II- Em um processo de expansão adiabática, ocorre um aumento no volume e diminuição na pressão.
III- A energia interna, para um processo de compressão adiabática, é igual à soma das energias na forma de calor e do trabalho realizado sobre o sistema.
É correto o que se afirma em:
-
A) III, apenas.
B) I, apenas.
C) II e III, apenas.
D) I, II e III.
E) II, apenas.


